Houbová těla - Mushroom bodies
Tyto houby těla nebo korpusy pedunculata jsou dvojice struktur v mozku z hmyzu , jiných členovců , a některé kroužkovci (zejména ragworm Platynereis dumerilii ). Je také známo, že hrají roli v čichovém učení a paměti . Ve většině hmyzu jsou těla hub a postranní roh dvě vyšší oblasti mozku, které přijímají čichové informace z anténního laloku prostřednictvím projekčních neuronů. Poprvé je identifikoval a popsal francouzský biolog Félix Dujardin v roce 1850.
Struktura
Houbová těla jsou obvykle popisována jako neuropily , tj. Jako husté sítě neuronálních procesů ( dendritové a axonové terminály ) a glia . Své jméno dostávají podle zhruba polokulového kalichu , výčnělku, který je se zbytkem mozku spojen centrálním nervovým traktem nebo stopkou .
Většina našich současných znalostí o tělech hub pochází ze studií několika druhů hmyzu, zejména švába Periplaneta americana , včely medonosné Apis mellifera , kobylky a ovocné mušky Drosophila melanogaster . Studie těl hub ovocných mušek byly zvláště důležité pro pochopení genetického základu fungování těla hub, protože jejich genom byl sekvenován a existuje velké množství nástrojů pro manipulaci s jejich genovou expresí.
V mozku hmyzu se stopky těl hub rozšiřují středním mozkem . Skládají se hlavně z dlouhých, hustě zabalených nervových vláken keňských buněk , vnitřních neuronů těl hub. Tyto buňky byly nalezeny v tělech hub všech zkoumaných druhů, i když se jejich počet liší. Například ovocných mušek je kolem 2500, zatímco švábů asi 200 000.
Funkce
Houbová těla jsou nejlépe známá pro svou roli v čichovém asociativním učení. Tyto čichové signály jsou přijímány z dopaminergních , octopaminergních , cholinergních , serotonergních a GABAergních neuronů mimo MB. Jsou největší u blanokřídlých , o nichž je známo, že mají obzvláště komplikovanou kontrolu nad čichovým chováním. Jelikož se však těla hub nacházejí také v anosmickém primitivním hmyzu, jejich role pravděpodobně přesahuje čichové zpracování. Anatomické studie naznačují roli u zpracování vizuálních a mechanosenzorických vstupů u některých druhů. Zejména u blanokřídlých jsou subregiony neuropilu těl hub specializovány na příjem čichových, zrakových nebo obou typů senzorických vstupů. U blanokřídlých je čichový vstup vrstvený v kalichu. U mravenců lze rozlišit několik vrstev, odpovídajících různým shlukům glomerulů v anténních lalocích , snad pro zpracování různých tříd pachů. Existují dvě hlavní skupiny projekčních neuronů rozdělujících anténní lalok na dvě hlavní oblasti, přední a zadní. Projekční neuronové skupiny jsou odděleny, inervují glomerulární skupiny odděleně a vysílají axony oddělenými cestami, buď mediálně-anténním protocerebrálním traktem (m-APT), nebo laterálně-anténním protocerebrálním traktem (l-APT), a spojují se dvěma vrstvami v kalich těl hub. V těchto vrstvách je topograficky znázorněna organizace dvou eferentních oblastí anténního laloku, čímž je vytvořena hrubá odotopická mapa anténního laloku v oblasti okraje těl hub.
O houbových tělech je známo, že se podílejí na učení a paměti , zejména pro čich , a proto jsou předmětem současného intenzivního výzkumu. U většího hmyzu studie naznačují, že těla hub mají další funkce učení a paměti, jako je asociativní paměť , senzorické filtrování, ovládání motoru a paměť míst. Výzkum naznačuje, že těla hub obecně fungují jako jakýsi detektor náhod , integrují multimodální vstupy a vytvářejí nová sdružení, což naznačuje jejich roli v učení a paměti. Nedávná práce také ukazuje důkazy o zapojení těla houby do vrozeného čichového chování prostřednictvím interakcí s laterálním rohem, případně s využitím částečně stereotypních senzorických reakcí výstupních neuronů těla hub (MBON) mezi jednotlivci. Přestože jsou spojení mezi projekčními neurony a kenyonskými buňkami náhodná (tj. Nejsou stereotypní mezi jednotlivci), stereotyp v MBON reakcích je možný díky husté konvergenci mnoha keňských buněk na několik MBON spolu s dalšími vlastnostmi sítě.
Informace o pachech mohou být v těle houby zakódovány identitami reagujících neuronů a také načasováním jejich špiček. Experimenty na kobylkách ukázaly, že keňské buňky mají svou aktivitu synchronizovanou s neurálními oscilacemi 20 Hz a jsou zvláště citlivé na špičky projekčních neuronů ve specifických fázích oscilačního cyklu.
Spát
Neurony, které přijímají signály ze serotonergních a GABAergních neuronů mimo MB, způsobují bdělost a experimentálně stimulují tyto serotonergní upstream neurony síly spánku. Cílové neurony v MB jsou inhibovány serotoninem , GABA a kombinací obou. Na druhou stranu se zdá, že octopamin neovlivňuje spánkovou funkci MB.
Drosophila melanogaster
Víme, že tělesné struktury hub jsou u Drosophily důležité pro čichové učení a paměť, protože jejich ablace tuto funkci ničí. Tělo houby je také schopno kombinovat informace z vnitřního stavu těla a čichového vstupu, aby určilo vrozené chování. Přesné role konkrétních neuronů tvořících těla hub jsou stále nejasné. Tyto struktury jsou však podrobně studovány, protože je mnoho známo o jejich genetickém složení . Existují tři specifické třídy neuronů, které tvoří tělní laloky hub: α/β, α '/β' a y neurony, které mají odlišnou genovou expresi. Tématem současného výzkumu je, které z těchto substruktur v houbovém těle jsou zahrnuty v každé fázi a procesu učení a paměti. Těla hub Drosophila jsou také často používána ke studiu učení a paměti a jsou manipulována kvůli jejich relativně diskrétní povaze. Testy čichového učení obvykle spočívají v samostatném vystavení much dvěma pachům; jeden je spárován s impulsy elektrického šoku ( podmíněný podnět nebo CS+) a druhý není ( nepodmíněný podnět nebo USA). Po tomto tréninku jsou mouchy umístěny do T-bludiště se dvěma pachy umístěnými jednotlivě na obou koncích horizontálních 'T' ramen. Vypočítává se procento much, které se vyhýbají CS+, přičemž vysoká míra vyhýbání se považuje za důkaz učení a paměti.
Stopy buněčné paměti
Nedávné studie kombinující kondicionování zápachu a buněčné zobrazování identifikovaly šest paměťových stop, které se shodují s molekulárními změnami v čichovém systému Drosophila . Tři z těchto stop jsou spojeny s ranou formací behaviorální paměti. Jedna taková stopa byla vizualizována v anténním laloku (AL) pomocí reportérových molekul synapto-pHluorinu . Bezprostředně po kondicionování se další sada projekčních neuronů v sadě osmi glomerulů v AL stane synapticky aktivována podmíněným zápachem a trvá pouze 7 minut. Druhá stopa je detekovatelná expresí GCaMP , a tedy zvýšením přílivu Ca 2+ v a '/β' axonech neuronů těla houby. Jedná se o dlouhodobější stopu, která trvá až jednu hodinu po kondicionování. Třetí paměťovou stopou je snížení aktivity předního párového laterálního neuronu, který působí jako supresor tvorby paměti prostřednictvím jednoho ze svých inhibičních GABAergních receptorů. Snížení reakce vápníku neuronů APL a následné snížení uvolňování GABA na těla hub přetrvávalo až 5 minut po kondicionování zápachu.
Stopa mezilehlé paměti závisí na expresi genu amn umístěného v dorzálních párových mediálních neuronech. Zvýšení přílivu vápníku a synaptického uvolňování, které inervuje těla hub, se stane detekovatelným přibližně 30 minut po spárování elektrického šoku s pachem a přetrvává nejméně hodinu. Obě dlouhodobé paměťové stopy, které byly mapovány, závisí na aktivitě a syntéze proteinů CREB a CaMKII a existují pouze po časově odděleném podmínění. První stopa je detekována v neuronech α/β mezi 9 a 24 hodinami po kondicionování a je charakterizována zvýšením přílivu vápníku v reakci na podmíněný zápach. Druhá stopa dlouhodobé paměti se tvoří v tělech hub γ a je detekována zvýšeným přílivem vápníku mezi 18 a 24 hodinami po kondicionování
dynamika cAMP
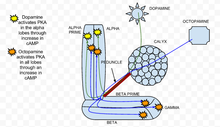
Cyklický adenosin monofosfát (cAMP nebo cyklický AMP) je druhým poslem, který se podílí na usnadnění přílivu vápníku tělem hub v tělních neuronech hub Drosophila melanogaster . Zvýšení cAMP indukuje u Drosophily presynaptickou plasticitu. Hladiny cAMP jsou ovlivněny jak neurotransmitery , jako je dopamin a octopamin , tak i samotnými pachy. Dopamin a octopamin jsou uvolňovány tělními interneurony hub , zatímco pachy přímo aktivují neurony v čichové dráze, což způsobuje příliv vápníku napěťově řízenými vápníkovými kanály .
V klasickém kondičním paradigmatu vede párování neuronální depolarizace (prostřednictvím aplikace acetylcholinu k reprezentaci zápachu nebo CS ) s následnou aplikací dopaminu (k reprezentaci šoku nebo USA ) k synergickému zvýšení cAMP v tělních lalocích hub. Tyto výsledky naznačují, že tělní laloky hub jsou kritickým místem integrace CS/USA působením cAMP. Tento synergický efekt byl původně pozorován v Aplysii , kde párování přílivu vápníku s aktivací signalizace G proteinu serotoninem generuje podobné synergické zvýšení cAMP.
Tento synergický nárůst cAMP je navíc zprostředkován adabilylylcyklázou rutabaga (rutina AC), která je citlivá jak na vápník (což je důsledkem otevírání napěťově řízeného vápníkového kanálu zápachem), tak na stimulaci G proteinu (způsobenou dopaminem). Zatímco dopředné párování neuronální depolarizace a dopaminu (acetylcholin následovaný dopaminem) vede k synergickému zvýšení cAMP, dopředné párování neuronální depolarizace a octopaminu produkuje sub-aditivní účinek na cAMP. Přesněji to znamená, že toto párování produkuje výrazně méně cAMP než součet každého stimulu jednotlivě v lalocích. Rutina AC v neuronech těl hub tedy funguje jako detektor shody s dopaminem a octopaminem, které fungují obousměrně a ovlivňují hladiny cAMP.
Dynamika PKA
Bylo zjištěno, že protein kináza A (PKA) hraje důležitou roli při učení a paměti u Drosophily . Když vápník vstupuje do buňky a váže se kalmodulinem , stimuluje adenylátcyklázu (AC), která je kódována genem rutabaga ( rut ). Tato AC aktivace zvyšuje koncentraci cAMP , která aktivuje PKA. Při aplikaci dopaminu , averzivního čichového stimulantu, se aktivuje PKA specificky ve svislých tělesných lalocích hub. Tato prostorová specificita je regulována dunce ( dnc ) PDE, cAMP-specifickou fosfodiesterázou . Pokud je gen dunce zrušen, jak bylo zjištěno u mutanta dnc , prostorová specificita není zachována. Naproti tomu apetitivní stimulace vytvořená aplikací octopaminu zvyšuje PKA ve všech lalocích. V mutantu rut , genotypu, ve kterém je rutabaga zrušena, byly reakce na dopamin i octopamin výrazně sníženy a blíží se experimentálnímu hluku.
Acetylcholin , který představuje podmíněný stimul , vede k silnému zvýšení aktivace PKA ve srovnání se stimulací samotným dopaminem nebo octopaminem. Tato reakce je u rutinních mutantů zrušena , což ukazuje, že PKA je nezbytná pro senzorickou integraci. Specifičnost aktivace alfa laloku v přítomnosti dopaminu je zachována, když je dopamin v kombinaci s acetylcholinem. V podstatě během paradigmatu klimatizace, kdy je podmíněný podnět spárován s nepodmíněným podnětem, PKA vykazuje zvýšenou aktivaci. To ukazuje, že PKA je nutná pro podmíněné učení v Drosophila melanogaster .
Apis mellifera
Stimul → výstupní reakce jsou součinem párů excitace a inhibice . Jedná se o stejný vzor organizace jako u mozků savců . Tyto vzorce mohou, stejně jako u savců, předcházet akci. Od roku 2021 je to oblast, kterou nedávno objasnili Zwaka et al 2018, Duer et al 2015 a Paffhausen et al 2020.
Viz také
Reference
Další čtení
- Martin Heisenberg (1998). „Co dělají houbová těla pro mozek hmyzu? Úvod“ . Učit se. Mem . 5 (1): 1–10. PMC 311238 . PMID 10454369 .
- SE Fahrbach (2006). „Struktura těl hub hmyzího mozku“. Annu. Rev. Entomol. 51 (3): 209–232. doi : 10.1006/jtbi.2001.2504 . PMID 12183125 .
- López-Riquelme, Germán Octavio (2008). Hormigas como sodemas para comportamiento complejo. Základy neurobiológie de la comunicación química y la división del trabajo en las hormigas (Ph.D.). Universidad Nacional Autónoma de México. doi : 10.13140/RG.2.1.3145.1689 .