Čištění hmyzem - Insect olfaction
Čichání hmyzem se týká funkce chemických receptorů, které umožňují hmyzu detekovat a identifikovat těkavé sloučeniny pro hledání potravy , vyhýbání se predátorům, hledání partnerů k páření (prostřednictvím feromonů ) a lokalizaci stanovišť s kladením vajíček . Pro hmyz je to tedy nejdůležitější pocit. Nejdůležitější chování hmyzu musí být dokonale načasováno, což závisí na tom, co voní a kdy to voní. Například čich je nezbytný pro lov mnoha druhů vos , včetně Polybia sericea .
Tyto dva orgány, které hmyz primárně používá k detekci pachů, jsou antény a specializované části úst nazývané maxilární palpy. Nedávná studie však prokázala čichovou roli ovipositora u vos voskových. Uvnitř těchto čichových orgánů jsou neurony zvané neurony čichových receptorů, které, jak název napovídá, obsahují ve své buněčné membráně receptory molekul vůně. Většina neuronů čichových receptorů obvykle sídlí v anténě . Tyto neurony mohou být velmi hojné, například mouchy Drosophila mají 2 600 čichových senzorických neuronů.
Hmyz je schopen citlivě i selektivně čichat a rozlišovat mezi tisíci těkavých sloučenin . Citlivost je, jak je hmyz naladěn na velmi malá množství odorantu nebo malé změny v koncentraci odorantu. Selektivita se týká schopnosti hmyzu rozeznat jeden odorant od druhého. Tyto sloučeniny se běžně dělí do tří tříd: karboxylové kyseliny s krátkým řetězcem , aldehydy a dusíkaté sloučeniny s nízkou molekulovou hmotností. Některý hmyz, jako je můra Deilephila elpenor , používá čich jako prostředek k nalezení zdrojů potravy.
Hmyz byl použit jako modelový systém pro studium savců a zejména lidské čichu . Na rozdíl od obratlovců, kteří používají receptory spřažené s G proteinem ( GPCR ), hmyz exprimuje proteiny včetně OR ( čichové receptory ), GR (chuťové receptory) a IR ( ionotropní receptory ), což jsou všechny heteromerní ligandem řízené iontové kanály . A druh můra v řádu Lepidoptera známé jako osenice ypsilonová můra ( Agrotis ipsilon ) produkuje ještě více bílkoviny, včetně OBPs ( odorantu-vázající proteiny ), CSP (chemosensorního vazebné proteiny), a SNMPs (senzorické neurony membránové proteiny), které pomůže můra rozpoznat sexuální feromony a odoranty, jako jsou ty, které se uvolňují z hostitelských rostlin. Stejně jako u obratlovců se axony ze senzorických neuronů sbíhají do glomerulů, ale liší se v tom, kde jsou glomeruly umístěny. U savců se nacházejí v čichových bulvách , ale u hmyzu v anténním laloku .
Čichová kaskáda
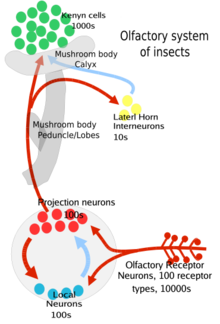
Senzorické neurony v anténě, čelistní dlani a štítcích generují pachově specifické elektrické signály zvané hroty ( akční potenciály ) v reakci na vazbu pachů na proteiny povrchu buněk, jako jsou čichové receptory . Senzorické neurony v anténě a maxillary posílají tyto informace prostřednictvím svých axonů do anténního laloku , zatímco senzorický neuron v štítku posílá tyto informace prostřednictvím axonů do subesophageal ganglion . Uvnitř anténního laloku se synchronizují s jinými neurony v semidelineálních (s membránovými hranicemi) strukturách zvaných glomeruly .
Konkrétně jde o následující postup: nejprve se pachová látka navine k anténě hmyzu nebo čelistní dlani, která je pokryta chlupatými výběžky nazývanými sensilla . Odorant pak vstupuje skrz drobné póry v exoskeletu (nebo kutikule) tohoto senzillum a difunduje do tekutiny mezi buňkami zvané extracelulární tekutiny . Molekula odorantu se zde váže na protein vázající odorant, který jej transportuje do týmu receptorů a ko-receptorů (Orco) na povrchu neuronu čichového receptoru (ORN). To vede k tomu, že neuron vystřelí akční potenciál dolů po axonu. Tento signál je odeslán do anténního laloku nebo subesophogeálního ganglia mozku hmyzu, kde pak může integrovat informace s jinými signály z jiných senzil .
Tyto ORN jsou bipolární, na jednom konci jsou čichové dendrity s receptory pro pachy a na druhém konci jsou axony, které nesou akční potenciál do anténního laloku mozku. Anténní laloky mají dva druhy neuronů, projekční neurony (většinou excitační) a lokální neurony (inhibiční, s některými excitačními). Projekční neurony posílají své axonové terminály do části hmyzího mozku zvané těla hub (důležité při regulaci naučených pachových reakcí) a další části mozku zvané laterální roh (důležité při regulaci vrozených pachových reakcí). Obě tyto oblasti jsou součástí protocerebrum hmyzího mozku.
Metody výzkumu
Záznamy akčního potenciálu se provádějí třemi různými způsoby - elektroantenogramy, elektropalpogramy a jednorázové záznamy (SSR). V elektroantenogramech (EAG) a elektropalpogramech (EPG) jsou zaznamenány akční potenciály z celé antény nebo maxilární palpy. EAG a EPG poskytují celkový pohled na čich v příslušném orgánu. Během SSR je elektroda vložena pouze do jednoho senzillum a záznam je proveden pouze z ORN, které jsou obsaženy v tomto senzillu, což poskytuje podrobnější informace .
Kteroukoli z těchto metod lze kombinovat s plynovou chromatografií s vysokým rozlišením k izolaci těkavých sloučenin z důležitých zvířat nebo stanovišť. Pomocí této metody lze například určit, která sloučenina z konkrétní květiny je pro včelku nejatraktivnější. Záznamy z projekčních neuronů ukazují, že u některých druhů hmyzu existuje silná specializace a diskriminace pro pachy prezentované ORN. To platí zejména pro projekční neurony makroglomerulů, specializovaný komplex glomerulů zodpovědných za detekci feromonů.
Repelenty a atraktanty
Lidé využívají čichový systém hmyzu ke kontrole zemědělských škůdců a chorob přenášejících choroby. U některých zemědělských škůdců jsou vyrobené sexuální feromony umístěny do pastí, aby zachytily dospělé, než se mohou rozmnožit (položit vajíčka), což vede k vylíhnutí jejich ničivých larev. I když existují tisíce chemikálií, které může hmyz detekovat, existuje omezený rozsah, který hmyz používá jako podněty k pohybu směrem ke zdroji odorantu nebo od něj.
Umění najít atraktant nebo repelent pro konkrétní hmyz, který nás zajímá, je komplikovaný a dlouhý a intenzivní proces. Například používání feromonů přitahuje hmyz pouze v reprodukčním stádiu, což je krátká doba jejich života. I když vůně jídla mohou být pro hladový hmyz atraktivní, na poli plném plodin, které by tomuto hmyzu chutnaly, by nebyly účinné.
Situačně závislé atraktanty / repelenty
Hmyz používá stejný signál pro mnoho různých použití v závislosti na situaci, která se nazývá chemická šetrnost. Situace, které mohou změnit způsob, jakým se hmyz chová v reakci na vůni, jsou například koncentrace sloučeniny, životní fáze hmyzu, stav páření, další čichové signály, stav krmení hmyzu (hladový nebo plný), doba den, nebo dokonce poloha těla hmyzu. Například Drosophila je velmi přitahována jablečným octem, ale ve velmi vysokých koncentracích je aktivován další čichový receptor (který má nízkou afinitu k octu, Or85a), který mění chování mouchy z přitažlivosti k averzi. Tato různá chování ke stejnému narážce se nazývá plasticita chování.
Oxid uhličitý
Mnoho hmyzu je schopno detekovat velmi malé změny v koncentraci CO 2 . I když bylo zjištěno, že CO 2 je atraktantem každého studovaného členovce a je velmi důležitý při monitorování a kontrole komárů, i tato stereotypní reakce může být plastická. Drosophila se při chůzi vyhýbá CO 2, ale za letu se k němu přibližuje.
DEET
Bylo ukázáno, že mnoho hmyzu (a dalších členovců) se vyhýbá oblastem obsahujícím N, N-diethyl-3-methylbenzamid nebo DEET . Přirozeně se vyhýbají DEET, pravděpodobně proto, že je to „zmatenec“, který stimuluje chuťové, ionotropní a čichové receptory a „narušuje“ interakci jiných odorantů s těmito receptory.
Viz také
Reference
- ^ a b c d e f Carraher, Colm; Dalziel, Julie; Jordan, Melissa D .; Christie, David L .; Newcomb, Richard D .; Kralicek, Andrew V. (2015). „Směrem k pochopení strukturálního základu pro čichání hmyzu receptory vonných látek“. Biochemie hmyzu a molekulární biologie . 66 : 31–41. doi : 10,1016/j.ibmb.2015.09.010 . PMID 26416146 .
- ^ a b c d e f Gadenne, Christophe; Barrozo, Romina B .; Anton, Sylvia (2016). „Plasticita při hnilobě hmyzu: Vonět nebo necítit?“. Výroční revize entomologie . 61 : 317–333. doi : 10,1146/annurev-ento-010715-023523 . PMID 26982441 .
- ^ a b c d e f g h i j k l Li, Qian; Liberles, Stephen D. (2015). „Averze a přitažlivost skrz Olfaction“ . Aktuální biologie . 25 (3): R120 – R1209. doi : 10.1016/j.cub.2014.11.044 . PMC 4317791 . PMID 25649823 .
- ^ Yadav, Pratibha; Borges, Renee M. (2017). „Hmyzový ovipositor jako těkavý senzor v uzavřeném mikrokosmu“ . Journal of Experimental Biology . 220 (9): 1554–1557. doi : 10,1242/jeb.152777 . PMID 28468812 .
- ^ a b c d e f g h i j k l Syed, Zainulabeuddin (2015). „Chemická ekologie a čich ve vektorech chorob členovců“. Aktuální názor ve vědě o hmyzu . 10 : 83–89. doi : 10,1016/j.cois.2015.04.011 . PMID 29588018 .
- ^ Gu, Shao-Hua; a kol. (2014). „Molekulární charakterizace a diferenciální exprese čichových genů v anténách můry černého červa Agrotis ipsilon “ . PLOSTE JEDEN . 9 (8): e103420. Bibcode : 2014PLoSO ... 9j3420G . doi : 10,1371/journal.pone.0103420 . PMC 4118888 . PMID 25083706 .
- ^ a b Wilson, Rachel (2013). „Časné čichové zpracování v Drosophile: mechanismy a principy“ . Výroční přehled neurovědy . 36 : 217–241. doi : 10,1146/annurev-neuro-062111-150533 . PMC 3933953 . PMID 23841839 .
- ^ Riabinina, Olena; Úkol, Darja; Marr, Elizabeth; Lin, Chun-Chieh; Alford, Robert; O'Brochta, David A .; Potter, Christopher J. (2016-10-03). „Organizace čichových center v komáří malárii Anopheles gambiae“ . Komunikace přírody . 7 : 13010. Bibcode : 2016NatCo ... 713010R . doi : 10,1038/ncomms13010 . PMC 5063964 . PMID 27694947 .