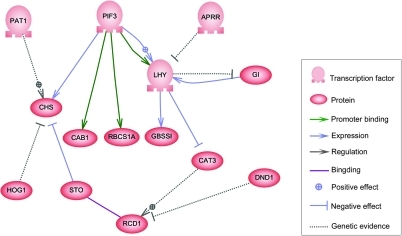
Genová regulační síť - Gene regulatory network
Gen (nebo genetický ) regulační sítě ( GRN ) je kolekce molekulárních regulátorů, které na sebe vzájemně působí, a s jinými látkami v buňce k řízení genové exprese hladiny mRNA a bílkoviny, která zase určují funkci buňky . GRN také hraje ústřední roli v morfogenezi , vytváření tělesných struktur, což je zase zásadní pro evoluční vývojovou biologii (evo-devo).
Regulátorem může být DNA , RNA , protein a jejich komplexy. Interakce může být přímá nebo nepřímá (prostřednictvím přepsané RNA nebo translatovaného proteinu). Obecně platí, že každá molekula mRNA pokračuje ve výrobě specifického proteinu (nebo sady proteinů). V některých případech bude tento protein strukturální a bude se akumulovat na buněčné membráně nebo v buňce, aby získal konkrétní strukturální vlastnosti. V jiných případech bude proteinem enzym , tj. Mikroprocesor, který katalyzuje určitou reakci, jako je rozpad zdroje potravy nebo toxinu. Některé proteiny však slouží pouze k aktivaci jiných genů, a to jsou transkripční faktory, které jsou hlavními hráči regulačních sítí nebo kaskád. Vazbou na promotorovou oblast na začátku jiných genů je zapnou, zahájí produkci dalšího proteinu atd. Některé transkripční faktory jsou inhibiční.
V jednobuněčných organizmech regulační sítě reagují na vnější prostředí a optimalizují buňku v daném čase pro přežití v tomto prostředí. Buňka kvasinek, která se ocitne v roztoku cukru, zapne geny, aby vytvořila enzymy, které zpracovávají cukr na alkohol. Tento proces, který spojujeme s výrobou vína, je způsob, jakým kvasinková buňka žije a získává energii na rozmnožování, což by za normálních okolností zlepšilo její vyhlídky na přežití.
U mnohobuněčných zvířat byl stejný princip zaveden do služby genových kaskád, které kontrolují tvar těla. Pokaždé, když se buňka rozdělí, vzniknou dvě buňky, které, ačkoliv obsahují úplně stejný genom, se mohou lišit v tom, které geny jsou zapnuty a vytvářejí bílkoviny. Někdy 'samonosná smyčka zpětné vazby' zajišťuje, že si buňka zachovává svoji identitu a předává ji dál. Méně chápaný je mechanismus epigenetiky, pomocí kterého může modifikace chromatinu poskytovat buněčnou paměť blokováním nebo umožněním transkripce. Hlavním rysem mnohobuněčných zvířat je použití morfogenních gradientů, které ve skutečnosti poskytují polohovací systém, který buňce říká, kde v těle je, a tedy jaký druh buňky se má stát. Gen zapnutý v jedné buňce může vytvořit produkt, který opustí buňku a difunduje sousedními buňkami, vstoupí do nich a zapne geny, pouze pokud je přítomen nad určitou prahovou úrovní. Tyto buňky jsou tak indukovány do nového osudu a mohou dokonce generovat další morfogeny, které signalizují zpět do původní buňky. Na delší vzdálenosti mohou morfogeny využívat aktivní proces přenosu signálu . Taková signalizace řídí embryogenezi , budování tělesného plánu od nuly prostřednictvím řady po sobě jdoucích kroků. Také kontrolují a udržují dospělá těla prostřednictvím procesů zpětné vazby a ztráta takové zpětné vazby v důsledku mutace může být zodpovědná za proliferaci buněk, která je pozorována u rakoviny . Souběžně s tímto procesem budování struktury genová kaskáda zapíná geny, které vytvářejí strukturální proteiny, které dávají každé buňce fyzické vlastnosti, které potřebuje.
Přehled
Na jedné úrovni lze biologické buňky považovat za „částečně smíšené vaky“ biologických chemikálií - v diskusi o sítích pro regulaci genů jde většinou o messenger RNA (mRNA) a proteiny, které vznikají z genové exprese. Tyto mRNA a proteiny na sebe vzájemně působí s různým stupněm specificity. Některé difundují kolem buňky. Jiné jsou vázány na buněčné membrány a interagují s molekulami v prostředí. Ještě další procházejí buněčnými membránami a zprostředkovávají signály dlouhého dosahu dalším buňkám v mnohobuněčném organismu. Tyto molekuly a jejich interakce obsahují síť pro regulaci genů . Typická síť pro regulaci genů vypadá nějak takto:
Uzly této sítě mohou představovat geny, proteiny, mRNA, komplexy protein/protein nebo buněčné procesy. Uzly, které jsou znázorněny jako ležící podél svislých čar, jsou spojeny s rozhraními buňka/prostředí, zatímco ostatní jsou volně plovoucí a mohou difundovat . Hrany mezi uzly představují interakce mezi uzly, které mohou odpovídat jednotlivým molekulárním reakcím mezi DNA, mRNA, miRNA, proteiny nebo molekulárními procesy, jejichž prostřednictvím produkty jednoho genu ovlivňují produkty jiného genu, ačkoli z nedostatku experimentálně získaných informací často vyplývá, že některé reakce nejsou modelovány na tak jemné úrovni detailů. Tyto interakce mohou být indukční (obvykle jsou znázorněny šipkami nebo znaménkem +), přičemž zvýšení koncentrace jednoho vede ke zvýšení druhého, inhibiční (znázorněno plnými kruhy, tupými šipkami nebo znaménkem mínus), s nárůstem v jednom vedoucí ke snížení druhého, nebo duální, když v závislosti na okolnostech může regulátor aktivovat nebo inhibovat cílový uzel. Uzly se mohou regulovat přímo nebo nepřímo a vytvářet smyčky zpětné vazby, které tvoří cyklické řetězce závislostí v topologické síti. Síťová struktura je abstrakcí molekulární nebo chemické dynamiky systému a popisuje rozmanité způsoby, kterými jedna látka ovlivňuje všechny ostatní, ke kterým je připojena. V praxi jsou takové GRN odvozeny z biologické literatury o daném systému a představují destilaci kolektivních znalostí o souboru souvisejících biochemických reakcí. Aby se urychlilo ruční vytvrzování GRN, některé nedávné snahy se pokoušejí použít k tomuto účelu těžbu textu , upravené databáze, odvozování sítě z masivních dat, kontrolu modelu a další technologie extrakce informací.
Na geny lze pohlížet jako na uzly v síti, přičemž vstupem jsou proteiny, jako jsou transkripční faktory , a na výstupech je úroveň genové exprese . Hodnota uzlu závisí na funkci, která závisí na hodnotě jejích regulátorů v předchozích časových krocích (v níže popsané booleovské síti se jedná o booleovské funkce , obvykle AND, OR a NOT). Tyto funkce byly interpretovány jako provádění určitého druhu zpracování informací v buňce, které určuje buněčné chování. Základními hybateli v buňkách jsou koncentrace některých proteinů, které určují jak prostorové (umístění v buňce nebo tkáni), tak časové (buněčný cyklus nebo vývojové stádium) souřadnice buňky, jako druh „buněčné paměti“. Genetickým sítím se teprve začíná rozumět a je dalším krokem biologie, aby se pokusil odvodit funkce pro každý „uzel“ genu, aby pomohl porozumět chování systému při zvyšování úrovně složitosti, od genu po signální dráhu , úroveň buňky nebo tkáně.
Byly vyvinuty matematické modely GRN, které zachycují chování modelovaného systému a v některých případech generují předpovědi odpovídající experimentálním pozorováním. V některých jiných případech se ukázalo, že modely vytvářejí přesné nové předpovědi, které lze experimentálně testovat, což naznačuje nové přístupy k prozkoumání experimentu, který by někdy nebyl brán v úvahu při návrhu protokolu experimentální laboratoře. Mezi modelovací techniky patří diferenciální rovnice (ODE), booleovské sítě , Petriho sítě , bayesovské sítě , grafické modely Gaussových sítí , Stochastic a Process Calculi . Naopak byly navrženy techniky pro generování modelů GRN, které nejlépe vysvětlují sadu pozorování časových řad . Nedávno se ukázalo, že signál ChIP-seq histonové modifikace více koreluje s motivy transkripčního faktoru na promotorech ve srovnání s hladinou RNA. Proto se navrhuje, aby ChIP-seq modifikace histonů v časové řadě mohla poskytnout spolehlivější odvození sítí regulačních genů ve srovnání s metodami založenými na úrovních exprese.
Struktura a evoluce
Globální funkce
Obecně se předpokládá, že genové regulační sítě jsou tvořeny několika vysoce propojenými uzly ( rozbočovači ) a mnoha špatně propojenými uzly vnořenými do hierarchického regulačního režimu. Sítě pro regulaci genů se tedy blíží topologii volné sítě v hierarchickém měřítku . To je v souladu s názorem, že většina genů má omezenou pleiotropii a působí v regulačních modulech . Tato struktura je myšlenka vyvíjet v důsledku přednostního upevnění z duplikovaných genů do více vysoce spojených genů. Nedávná práce také ukázala, že přirozený výběr dává přednost sítím s řídkým připojením.
Sítě se mohou primárně vyvíjet dvěma způsoby, přičemž oba mohou probíhat současně. První je, že topologii sítě lze změnit sčítáním nebo odčítáním uzlů (genů) nebo že části sítě (moduly) mohou být vyjádřeny v různých kontextech. Drosophila Hippo signální dráhy je dobrým příkladem. Signálová cesta hrocha řídí jak mitotický růst, tak post-mitotickou buněčnou diferenciaci. Nedávno bylo zjištěno, že síť, v níž signální dráha Hroch funguje, se mezi těmito dvěma funkcemi liší, což zase mění chování signální dráhy Hrocha. To naznačuje, že signalizační cesta Hippo funguje jako konzervovaný regulační modul, který lze použít pro více funkcí v závislosti na kontextu. Změna topologie sítě tedy může umožnit konzervovanému modulu obsluhovat více funkcí a měnit konečný výstup sítě. Druhým způsobem, jakým se mohou sítě vyvíjet, je změna síly interakcí mezi uzly, například toho, jak silně se transkripční faktor může vázat na cis-regulační prvek. Ukázalo se, že takové rozdíly v síle okrajů sítě jsou základem mezi druhovou variací ve vzorcích osudu buněk vulvy červů Caenorhabditis .
Místní funkce
Další široce citovanou charakteristikou genové regulační sítě je jejich množství určitých opakujících se podsítí známých jako síťové motivy . Při dělení velké sítě na malé bloky lze síťové motivy považovat za opakující se topologické vzorce. Předchozí analýza zjistila několik typů motivů, které se objevovaly častěji v sítích pro regulaci genů než v náhodně generovaných sítích. Jeden takový motiv se například nazývá smyčky zpětné vazby, které se skládají ze tří uzlů. Tento motiv je nejhojnější ze všech možných motivů tvořených třemi uzly, jak je ukázáno v genových regulačních sítích much, hlístic a lidí.
Obohacené motivy byly navrženy tak, aby sledovaly konvergentní evoluci , což naznačuje, že jsou „optimálním designem“ pro určité regulační účely. Modelování například ukazuje, že smyčky zpětné vazby jsou schopny koordinovat změnu v uzlu A (z hlediska koncentrace a aktivity) a dynamiku výrazu uzlu C, což vytváří různé chování vstupu a výstupu. Systém využití galaktózy E. coli obsahuje dopřednou smyčku, která urychluje aktivaci operonu galETK využívajícího galaktosu , což potenciálně usnadňuje metabolický přechod na galaktózu, když je glukóza vyčerpána. Zpětnovazební smyčka v systémech využití arabinosy E.coli zpomaluje aktivaci operonu a transportérů arabinózového katabolismu, což potenciálně zamezuje zbytečnému metabolickému přechodu v důsledku dočasných výkyvů v upstream signálních drahách. Podobně v Wnt signální dráze Xenopus funguje dopředná smyčka jako detektor přehybů, který reaguje na změnu záhybu, nikoli na absolutní změnu, v hladině β-kateninu, což potenciálně zvyšuje odolnost vůči výkyvům v β -hladiny kateninu. Podle hypotézy konvergentní evoluce by obohacení dopředných smyček bylo adaptací pro rychlou odezvu a odolnost proti hluku. Nedávný výzkum zjistil, že kvasinky pěstované v prostředí s konstantní glukózou vyvinuly mutace v glukózových signálních cestách a v cestě regulace růstu, což naznačuje, že regulační složky reagující na změny prostředí jsou za stálého prostředí postradatelné.
Na druhé straně někteří badatelé předpokládají, že obohacování síťových motivů je neadaptivní. Jinými slovy, regulační sítě genů se mohou vyvinout do podobné struktury bez specifického výběru navrhovaného chování vstupu a výstupu. Podpora pro tuto hypotézu často pochází z výpočetních simulací. Například fluktuace hojnosti zpětnovazebních smyček v modelu, který simuluje vývoj genových regulačních sítí náhodným přepojováním uzlů, může naznačovat, že obohacení zpětnovazebních smyček je vedlejším účinkem evoluce. V dalším modelu evoluce sítí regulátorů genů ukazuje poměr frekvencí duplikace genů a delece genů velký vliv na topologii sítě: určité poměry vedou k obohacení zpětnovazebních smyček a vytvářejí sítě, které vykazují rysy sítí v hierarchickém měřítku. De novo evoluce koherentních dopředných smyček typu 1 byla prokázána výpočetně v reakci na výběr pro jejich hypotetickou funkci odfiltrování krátkého rušivého signálu, podporující adaptivní evoluci, ale pro neidealizovaný hluk, systém založený na dynamice místo toho byla upřednostňována dopředná regulace s odlišnou topologií.
Bakteriální regulační sítě
Regulační sítě umožňují bakteriím přizpůsobit se téměř každému prostředí na Zemi. Síť interakcí mezi různými typy molekul včetně DNA, RNA, proteinů a metabolitů využívá bakterie k dosažení regulace genové exprese. U bakterií je hlavní funkcí regulačních sítí kontrola reakce na změny prostředí, například stav výživy a stres v životním prostředí. Složitá organizace sítí umožňuje mikroorganismu koordinovat a integrovat více environmentálních signálů.
Modelování
Sdružené obyčejné diferenciální rovnice
Je běžné modelovat takovou síť pomocí sady spojených obyčejných diferenciálních rovnic ( ODE ) nebo SDE , popisujících kinetiku reakce jednotlivých složek. Předpokládejme, že naše regulační síť má uzly a nechť představuje koncentrace odpovídajících látek v čase . Potom lze časový vývoj systému popsat přibližně pomocí
kde funkce vyjadřují závislost na koncentracích jiných látek přítomných v buňce. Funkce jsou nakonec odvozeny ze základních principů chemické kinetiky nebo jednoduchých výrazů odvozených z těchto např. Enzymatické kinetiky Michaelis – Menten . Funkční formy jsou proto obvykle voleny jako polynomy nízkého řádu nebo Hillovy funkce, které slouží jako odpověď na skutečnou molekulární dynamiku. Takové modely jsou poté studovány pomocí matematiky nelineární dynamiky . Informace specifické pro systém, jako jsou konstanty reakční rychlosti a citlivosti, jsou kódovány jako konstantní parametry.
Řešením pro pevný bod systému:
pro všechny se získá (možná několik) koncentračních profilů proteinů a mRNA, které jsou teoreticky udržitelné (i když ne nutně stabilní ). Ustálené stavy kinetických rovnic tedy odpovídají potenciálním buněčným typům a oscilační řešení výše uvedené rovnice přirozeně cyklickým buněčným typům. Matematická stabilita těchto atraktorů může být obvykle charakterizována znamením vyšších derivátů v kritických bodech a pak odpovídá biochemické stabilitě koncentračního profilu. Kritické body a bifurkace v rovnicích odpovídají kritickým stavům buněk, ve kterých by malé stavové nebo parametrické poruchy mohly přepínat systém mezi jedním z několika stabilních diferenciačních osudů. Trajektorie odpovídají vývoji biologických drah a přechodových jevů rovnic ke krátkodobým biologickým událostem. Více matematických diskusí najdete v článcích o nelinearitě , dynamických systémech , teorii bifurkace a teorii chaosu .
Booleovská síť
Následující příklad ilustruje, jak může booleovská síť modelovat GRN společně s jejími genovými produkty (výstupy) a látkami z prostředí, které jej ovlivňují (vstupy). Stuart Kauffman byl jedním z prvních biologů, kteří použili metaforu booleovských sítí k modelování genetických regulačních sítí.
- Každý gen, každý vstup a každý výstup je reprezentován uzlem v usměrněném grafu, ve kterém je šipka z jednoho uzlu do druhého právě tehdy, pokud existuje příčinná souvislost mezi těmito dvěma uzly.
- Každý uzel v grafu může být v jednom ze dvou stavů: zapnutý nebo vypnutý.
- U genu „on“ odpovídá genu, který je exprimován; u vstupů a výstupů „vypnuto“ odpovídá přítomné látce.
- Čas je považován za postupující v diskrétních krocích. V každém kroku je nový stav uzlu booleovskou funkcí předchozích stavů uzlů se šipkami směřujícími k němu.
Platnost modelu lze testovat porovnáním výsledků simulace s pozorováním časových řad. Částečné ověření booleovského síťového modelu může také pocházet z testování předpokládané existence dosud neznámého regulačního spojení mezi dvěma konkrétními transkripčními faktory, z nichž každý je uzlem modelu.
Spojité sítě
Souvislé síťové modely GRN jsou rozšířením výše popsaných booleovských sítí. Uzly stále představují geny a spojení mezi nimi regulační vlivy na genovou expresi. Geny v biologických systémech vykazují kontinuální rozsah úrovní aktivity a bylo argumentováno, že použití kontinuální reprezentace zachycuje několik vlastností genových regulačních sítí, které nejsou přítomny v booleovském modelu. Formálně je většina těchto přístupů podobná umělé neuronové síti , protože vstupy do uzlu jsou sečteny a výsledek slouží jako vstup do sigmoidní funkce, např. Ale proteiny často kontrolují genovou expresi v synergickém, tj. Nelineárním, způsob. Nyní však existuje kontinuální síťový model, který umožňuje seskupování vstupů do uzlu, čímž je realizována další úroveň regulace. Tento model je formálně blíže rekurentní neuronové síti vyššího řádu . Stejný model byl také použit k napodobení evoluce buněčné diferenciace a dokonce i mnohobuněčné morfogeneze .
Stochastické genové sítě
Nedávné experimentální výsledky prokázaly, že genová exprese je stochastický proces. Mnoho autorů tedy nyní používá stochastický formalismus, po práci Arkin et al. Práce na expresi jednoho genu a malých syntetických genetických sítích, jako je genetický přepínač Tim Gardner a Jim Collins , poskytly další experimentální data o fenotypové variabilitě a stochastické povaze genové exprese. První verze stochastických modelů genové exprese zahrnovaly pouze okamžité reakce a byly řízeny Gillespieho algoritmem .
Protože některé procesy, jako je transkripce genu, zahrnují mnoho reakcí a nemohly být správně modelovány jako okamžitá reakce v jediném kroku, bylo navrženo modelovat tyto reakce jako jednostupňové vícenásobné zpožděné reakce, aby se zohlednil čas, který je zapotřebí pro aby byl celý proces dokončen.
Odtud byla navržena řada reakcí, které umožňují generování GRN. Ty jsou poté simulovány pomocí upravené verze Gillespieho algoritmu, který dokáže simulovat více časově zpožděných reakcí (chemické reakce, kde je každému z produktů poskytnuto časové zpoždění, které určuje, kdy bude v systému uvolněn jako „hotový výrobek“) .
Základní transkripci genu lze například reprezentovat následující jednostupňovou reakcí (RNAP je RNA polymeráza, RBS je vazebné místo pro ribozomy RNA a Pro i je promotorová oblast genu i ):
Kromě toho se zdá, že existuje kompromis mezi hlukem v genové expresi, rychlostí, s níž se geny mohou přepínat, a metabolickými náklady spojenými s jejich fungováním. Přesněji řečeno, pro jakoukoli danou úroveň metabolických nákladů existuje optimální kompromis mezi hlukem a rychlostí zpracování a zvýšení metabolických nákladů vede k lepším kompromisům mezi rychlostí a hlukem.
Nedávná práce navrhla simulátor (SGNSim, Stochastic Gene Networks Simulator ), který dokáže modelovat GRN, kde jsou transkripce a překlad modelovány jako více časově zpožděných událostí a jeho dynamika je řízena stochastickým simulačním algoritmem (SSA) schopným vypořádat se s více časově zpožděnými Události. Časová zpoždění lze čerpat z několika distribucí a reakčních rychlostí z komplexních funkcí nebo z fyzikálních parametrů. SGNSim může generovat soubory GRN v rámci sady parametrů definovaných uživatelem, jako je topologie. Lze jej také použít k modelování konkrétních GRN a systémů chemických reakcí. Modelovat lze také genetické poruchy, jako jsou delece genů, nadměrná exprese genu, inzerce, mutace posunu rámce.
GRN je vytvořen z grafu s požadovanou topologií, který ukládá distribuce v stupních a mimo stupně. Činnosti promotoru genu jsou ovlivněny jinými produkty pro expresi genů, které působí jako vstupy, ve formě monomerů nebo kombinované do multimerů a nastavené jako přímé nebo nepřímé. Dále je každý přímý vstup přiřazen k místu operátora a mohou nebo nemusí být povoleny různé transkripční faktory soutěžit o stejné místo operátora, zatímco nepřímé vstupy mají cíl. Nakonec je každému genu přiřazena funkce, která definuje odpověď genu na kombinaci transkripčních faktorů (stav promotoru). Přenosové funkce (tj. Jak geny reagují na kombinaci vstupů) lze podle potřeby přiřadit každé kombinaci stavů promotoru.
V další nedávné práci byly vyvinuty víceúrovňové modely genových regulačních sítí, které se zaměřují na aplikace syntetické biologie. Byly použity simulace, které modelují všechny biomolekulární interakce při transkripci, translaci, regulaci a indukci genových regulačních sítí, přičemž se řídí návrh syntetických systémů.
Předpověď
Další práce se zaměřila na predikci úrovní genové exprese v genové regulační síti. Přístupy použité k modelování regulačních sítí genů byly omezeny tak, aby byly interpretovatelné, a v důsledku toho jsou obecně zjednodušenými verzemi sítě. Booleovské sítě byly například použity kvůli jejich jednoduchosti a schopnosti zpracovávat hlučná data, ale ztrácejí informace o datech tím, že mají binární reprezentaci genů. Umělé neurální sítě také vynechávají skrytou vrstvu, aby je bylo možné interpretovat, čímž ztrácejí schopnost modelovat v datech korelace vyššího řádu. Pomocí modelu, který není omezen na interpretovatelnost, lze vytvořit přesnější model. Schopnost přesněji předpovídat genovou expresi poskytuje způsob, jak prozkoumat, jak léky ovlivňují systém genů, a také zjistit, které geny jsou v procesu vzájemně propojeny. K tomu přispěla soutěž DREAM, která propaguje soutěž o nejlepší predikční algoritmy. Některé další nedávné práce používají umělé neuronové sítě se skrytou vrstvou.
Aplikace
Roztroušená skleróza
Existují tři třídy roztroušené sklerózy: relaps-remitující (RRMS), primární progresivní (PPMS) a sekundární progresivní (SPMS). Genová regulační síť (GRN) hraje zásadní roli pro pochopení mechanismu onemocnění v těchto třech různých třídách roztroušené sklerózy.
Viz také
- Tělesný plán
- Cis-regulační modul
- Genenetwork (databáze)
- Morphogen
- Operon
- Syxprese
- Systémová biologie
- Vážená analýza genové koexpresní sítě
Reference
Další čtení
- Bolouri H, Bower JM (2001). Výpočetní modelování genetických a biochemických sítí . Cambridge, Mass: MIT Press. ISBN 978-0-262-02481-5.
- Kauffman SA (březen 1969). „Metabolická stabilita a epigeneze v náhodně konstruovaných genetických sítích“. Journal of Theoretical Biology . 22 (3): 437–67. doi : 10,1016/0022-5193 (69) 90015-0 . PMID 5803332 .
externí odkazy
- Databáze faktorů transkripce rostlin a platforma pro analýzu a transkripční regulaci rostlin
- Open source webová služba pro analýzu GRN
- BIB: Prohlížeč biologických interakcí kvasinek
- Grafické Gaussovy modely pro data genomu - odvození asociací genových sítí s GGM
- Bibliografie o učení kauzálních sítí genových interakcí - pravidelně aktualizovaná, obsahuje stovky odkazů na články z bioinformatiky, statistiky, strojového učení.
- https://web.archive.org/web/20060907074456/http://mips.gsf.de/proj/biorel/ BIOREL je webový zdroj pro kvantitativní odhad zkreslení genové sítě ve vztahu k dostupným informacím o databázi genová aktivita/funkce/vlastnosti/asociace/interakce.
- Vyvíjející se biologické hodiny pomocí genetických regulačních sítí - informační stránka se zdrojovým kódem modelu a Java appletem.
- Navržené genové sítě
- Tutorial: Genetic Algorithms and their application to the Artificial Evolution of Genetic Regulatory Networks
- BEN: webový zdroj pro zkoumání spojení mezi geny, nemocemi a dalšími biomedicínskými entitami
- Globální interakce protein-protein a síť pro regulaci genů Arabidopsis thaliana