Sonic Ježek - Sonic hedgehog
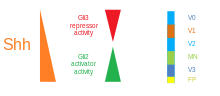
Sonic hedgehog je protein kódovaný pro gen SHH. Tato signální molekula je klíčová při regulaci embryonální morfogeneze u všech různých typů zvířat. SHH řídí organogenezi a organizaci centrálního nervového systému, končetin, číslic a mnoha dalších částí těla. Sonický ježek je morfogen, který modeluje vyvíjející se embryo pomocí koncentračního gradientu charakterizovaného modelem francouzské vlajky . Tento model má nejednotnou distribuci molekul SHH, která řídí různé buněčné osudy podle koncentrace. Mutace v tomto genu mohou způsobit holoprosencefálii , selhání štěpení v mozkových hemisférách, jak bylo ukázáno v experimentu s použitím knock-out myší SHH, u nichž se středová linie předního mozku nevyvinula a místo toho vznikla pouze jedna fúzovaná telencefalická váček. Sonic ježek stále hraje roli v diferenciaci, proliferaci a udržování tkání dospělých. Abnormální aktivace signalizace SHH v dospělých tkáních se podílí na různých typech rakoviny, včetně prsu, kůže, mozku, jater, žlučníku a mnoha dalších.
Objev a nomenklatura
Gen ježka ( hh ) byl poprvé identifikován v ovocné mušce Drosophila melanogaster na klasických Heidelbergských obrazovkách Christiane Nüsslein-Volhard a Eric Wieschaus , jak byly publikovány v roce 1980. Tyto obrazovky- což vedlo k tomu, že v roce 1995 získali Nobelovu cenu spolu s vývojový genetik Edward B. Lewis - identifikované geny, které kontrolují segmentační vzor embryí Drosophila . Hh ztráta funkce mutantního fenotypu způsobí, že embrya, které mají být pokryty denticles-tj malé špičaté výstupky připomínající hroty na ježka . Vyšetřování zaměřená na nalezení ekvivalentu ježka u obratlovců provedli Philip Ingham , Andrew P. McMahon a Clifford Tabin a odhalili tři homologní geny .
Dva z těchto genes- pouštní ježek a indické ježek -were jmenovány pro druhy ježků, zatímco Sonic ježek byl pojmenován po Sonic the Hedgehog , titulární protagonista na stejnojmenné herní série . Tento gen pojmenoval Robert Riddle, který byl postdoktorandem v laboratoři Tabin , poté, co se jeho manželka Betsy Wilder vrátila domů s herním časopisem obsahujícím inzerát na videohru Sonic the Hedgehog . V zebrafish jsou duplikovány dva ze tří genů hh obratlovců : SHH a a SHH b (dříve popsáno jako tiggywinkle ježek , pojmenované po paní Tiggy-Winkle , postavě z knih Beatrix Potterové pro děti) a ihha a ihhb ( dříve popsán jako ježko echidna , pojmenovaný pro ostnatého mravenečníka a ne pro postavu Knuckles the Echidna v Sonic franšíze).
Funkce
Z homologů hh bylo zjištěno , že SHH má ve vývoji nejkritičtější role a působí jako morfogen zapojený do modelování mnoha systémů - včetně přední hypofýzy , pallium mozku, míchy , plic , zubů a thalamu ze strany zóny limitans intrathalamica . V vertebrates, vývoj z končetin a číslic je závislá na sekreci zvukového ježka od zóny polarizační aktivity , který se nachází na zadní straně embryonálního končetiny zárodku . Mutace v lidském zvukovém ježicovém genu SHH způsobují holoprosencefalii typu 3 HPE3 v důsledku ztráty ventrální střední linie. Transkripční dráha sonického ježka byla také spojena s tvorbou specifických druhů rakovinných nádorů, včetně embryonálního cerebelárního nádoru a meduloblastomu , stejně jako s progresí nádorů rakoviny prostaty . Aby byla SHH exprimována ve vyvíjejících se končetinách embrya, musí být z apikálního ektodermálního hřbetu vylučován morfogen nazývaný fibroblastové růstové faktory .
Bylo také ukázáno, že zvukový ježek funguje jako axonální vodicí narážka . Bylo prokázáno, že SHH přitahuje komisurální axony ve ventrální střední linii vyvíjející se míchy. SHH konkrétně přitahuje axony sítnicových gangliových buněk (RGC) při nízkých koncentracích a odpuzuje je při vyšších koncentracích. Ukázalo se, že absence (neexprese) SHH kontroluje růst rodících se zadních končetin u kytovců ( velryb a delfínů ).
SHH gen je členem genové rodiny ježek s pěti variací sekvence DNA změny nebo sestřihové varianty. SHH se nachází na sedmém chromozomu a zahajuje produkci proteinu Sonic Hedgehog. Tento protein vysílá do embryonálních tkání signály krátkého a dlouhého dosahu, aby reguloval vývoj. Pokud je gen SHH mutován nebo chybí, protein Sonic Hedgehog nemůže správně vykonávat svou práci. Sonic ježek přispívá k růstu buněk, specifikaci a tvorbě buněk, strukturování a organizaci tělesného plánu. Tento protein funguje jako vitální morfogenní signální molekula a hraje důležitou roli při tvorbě mnoha různých struktur při vývoji embryí. SHH gen ovlivňuje několik hlavních orgánových systémů, jako je například nervového systému, kardiovaskulární systém, respirační systém a pohybový aparát. Mutace v genu SHH mohou způsobit malformaci součástí těchto systémů, což může mít za následek velké problémy ve vývoji embrya. Například mozek a oči mohou být významně ovlivněny mutacemi v tomto genu a způsobit poruchy, jako je Microphthalmia a Holoprosencephaly . Mikroftalmie je stav, který postihuje oči, což má za následek malé, nedostatečně vyvinuté tkáně v jednom nebo obou očích. To může vést k problémům od kolobomu přes jedno malé oko až po úplnou absenci očí. Holoprosencefalie je stav, který je nejčastěji způsoben mutací genu SHH, která způsobuje nesprávné oddělení levého a pravého mozku a obličejové dysmorfie. Mnoho systémů a struktur do značné míry spoléhá na správnou expresi genu SHH a následného sonického ježčího proteinu, čímž získává vyznamenání za to, že je nezbytným genem pro vývoj.
Vzorování centrálního nervového systému
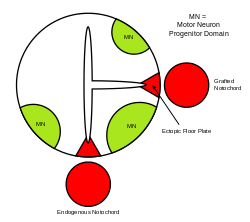
Signalizační molekula sonického ježka (SHH) přebírá různé role při modelování centrálního nervového systému (CNS) během vývoje obratlovců . Jednou z nejvíce charakterizovaných funkcí SHH je její role v indukci podlahové desky a různých typů ventrálních buněk v nervové trubici . Notochord -a struktury odvozené od axiálního mezodermu -produces SHh, které jezdí extracelulárně do ventrální oblasti nervové trubice a instruuje těchto buněk tvořit podlahovou desku. Jiný pohled na indukci podlahové desky předpokládá, že některé prekurzorové buňky umístěné v notochordu jsou vloženy do nervové desky před jejím vytvořením, což později vede k podlahové desce.
Samotná neurální trubice je počátečním základem obratlovce CNS a podlahová deska je specializovaná struktura umístěná ve ventrálním středu neurální trubice. Důkazy podporující notochord jako signální centrum pocházejí ze studií, ve kterých je druhý notochord implantován v blízkosti neurální trubice in vivo, což vede k vytvoření ektopické podlahové desky v neurální trubici.
Sonický ježek je vylučovaný protein, který zprostředkovává signalizační aktivity notochordu a podlahové desky. Studie zahrnující ektopickou expresi ve SHH in vitro a in vivo za následek indukci podlahovou deskou a diferenciaci z motoneuronu a ventrální interneuronech . Na druhé straně myší mutanti pro SHH postrádají ventrální míchu. In vitro blokování signalizace SHH pomocí protilátek proti ní vykazuje podobné fenotypy. SHH uplatňuje své účinky v závislosti na koncentraci, aby vysoká koncentrace SHH za následek lokální inhibici z buněčné proliferace . Tato inhibice způsobí, že podlahová deska ve srovnání s laterálními oblastmi nervové trubice ztenčí . Nižší koncentrace SHH vede k buněčné proliferaci a indukci různých typů ventrálních nervových buněk. Jakmile je etážová deska ustavena, buňky sídlící v této oblasti následně samy exprimují SHH, čímž se v nervové trubici vytvoří koncentrační gradient .
Ačkoli neexistuje žádný přímý důkaz gradientu SHH , existuje nepřímý důkaz prostřednictvím vizualizace exprese genu Patched ( Ptc ) , která kóduje doménu vázající ligand receptoru SHH v celé ventrální nervové trubici. Studie in vitro ukazují, že přírůstkové dvojité a trojnásobné změny koncentrace SHH vedou ke vzniku motorických neuronů a různých interneuronálních podtypů, které se nacházejí ve ventrální míše. Tyto inkrementální změny in vitro odpovídají vzdálenosti domén od signální tkáně (notochord a floor plate), která se následně diferencuje na různé neuronální podtypy, jak se vyskytuje in vitro . Navrhuje se, aby odstupňovaná signalizace SHH byla zprostředkována prostřednictvím rodiny proteinů Gli , což jsou homologové obratlovců transkripčního faktoru Drosophila obsahujícího zinkový prst Cubitus interruptus ( Ci ). Ci je klíčovým prostředníkem signalizace ježka ( Hh ) v Drosophile . U obratlovců jsou přítomny tři různé Gli proteiny, tj. Gli1 , Gli2 a Gli3 , které jsou exprimovány v nervové trubice. Myší mutanti pro Gli1 vykazují normální vývoj míchy, což naznačuje, že je postradatelný pro zprostředkování aktivity SHH. Myši s mutací Gli2 však vykazují abnormality ve ventrální míše, s vážnými defekty v podlahové desce a ventrálně nejvíce interneuronech (V3). Gli3 antagonizuje funkci SHh v dávce závislou způsobem, propagaci hřbetní neuronální podtypy. Fenotypy mutantů SHH lze zachránit v dvojitém mutantu SHH/Gli3 . Gli proteiny mají C-koncovou aktivační doménu a N-koncovou represivní doménu.
Navrhuje se, aby SHH podporoval aktivační funkci Gli2 a inhiboval represivní aktivitu Gli3. Zdá se, že SHH také podporuje aktivační funkci Gli3, ale tato aktivita není dostatečně silná. Odstupňovaná koncentrace SHH vede ke stupňované aktivitě Gli 2 a Gli3, které podporují ventrální a dorzální neuronální podtypy ve ventrální míše. Důkazy z mutantů Gli3 a SHH/Gli3 ukazují, že SHH primárně reguluje prostorové omezení progenitorových domén, než aby byla induktivní, protože mutanti SHH/Gli3 vykazují promísení buněčných typů.
SHH také indukuje další proteiny, se kterými interaguje, a tyto interakce mohou ovlivnit citlivost buňky vůči SHH. Protein interagující s ježkem ( HHIP ) je indukován SHH, což zase oslabuje jeho signální aktivitu. Vitronektin je další protein, který je indukován SHH; působí jako povinný kofaktor pro signalizaci SHH v neurální trubici.
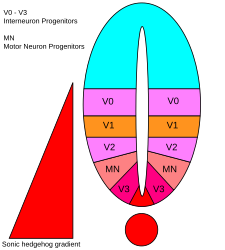
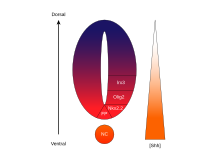
Ve ventrální neurální trubici je pět odlišných progenitorových domén: interneurony V3 , motorické neurony (MN), interneurony V2 , V1 a V0 (ve ventrálním až dorzálním řádu). Tyto různé progenitorové domény jsou založeny „komunikací“ mezi různými třídami transkripčních faktorů homeoboxu . (Viz trigeminální nerv .) Tyto transkripční faktory reagují na koncentraci gradientu SHH. V závislosti na povaze jejich interakce s SHH, které jsou rozděleny do dvou skupin, třídy I a třídy II, a jsou složeny ze členů Pax , Nkx , dbx a IRx rodin. Proteiny třídy I jsou potlačeny na různých prahových hodnotách SHH vymezujících ventrální hranice progenitorových domén , zatímco proteiny třídy II jsou aktivovány na různých prahových hodnotách SHH vymezujících dorzální limit domén. Selektivní křížově represivní interakce mezi proteiny třídy I a třídy II vedou k pěti kardinálním ventrálním neuronálním podtypům.
Je důležité si uvědomit, že SHH není jedinou signální molekulou, která má vliv na vyvíjející se neurální trubici. Aktivních je mnoho dalších molekul, cest a mechanismů (např. RA , FGF , BMP ) a jsou možné komplexní interakce mezi SHH a jinými molekulami. Předpokládá se, že BMP hrají rozhodující roli při určování citlivosti neurálních buněk na signalizaci SHH. Důkazy, které to podporují, pocházejí ze studií využívajících inhibitory BMP, které ventralizují osud buňky neurální ploténky pro danou koncentraci SHH. Na druhou stranu, mutace v antagonistech BMP (např. Noggin ) produkuje závažné defekty ve většině ventrálních charakteristik míchy, následované ektopickou expresí BMP ve ventrální neurální trubici. Interakce SHH s Fgf a RA nebyly dosud molekulárně podrobně studovány.
Morfogenetická aktivita
Koncentrace a časově závislá aktivita SHH určující buněčný osud ve ventrální neurální trubici z něj činí ukázkový příklad morfogenu . U obratlovců je signalizace SHH ve ventrální části neurální trubice nejvýrazněji zodpovědná za indukci buněk podlahové desky a motorických neuronů . SHH vychází z notochordu a ventrální podlahové desky vyvíjející se neurální trubice a vytváří koncentrační gradient, který překlenuje dorso-ventrální osu a je antagonizován inverzním Wnt gradientem, který specifikuje dorzální spinální akord. Vyšší koncentrace ligandu SHH se nacházejí ve většině ventrálních aspektech neurální trubice a notochordu, zatímco nižší koncentrace se nacházejí v dorzálních oblastech neurální trubice. Koncentrační gradient SHH byl vizualizován v nervové trubici myší konstruovaných tak, aby exprimovaly fúzní protein SHH :: GFP, aby se projevila tato odstupňovaná distribuce SHH v době vzorování ventrální neurální trubice.
Má se za to, že SHH gradient funguje k vyvolání více různých buněčných osudů mechanismem závislým na koncentraci a čase, který ve ventrálních progenitorových buňkách indukuje různé transkripční faktory . Každá z ventrálních progenitorových domén exprimuje vysoce individualizovanou kombinaci transkripčních faktorů - Nkx2.2, Olig2, Nkx6.1, Nkx6.2, Dbx1, Dbx2, Irx3, Pax6 a Pax7 - která je regulována gradientem SHH. Tyto transkripční faktory jsou indukovány postupně podél gradientu koncentrace SHH s ohledem na množství a dobu expozice ligandu SHH. Jak každá populace progenitorových buněk reaguje na různé hladiny SHH proteinu, začnou exprimovat jedinečnou kombinaci transkripčních faktorů, která vede k diferenciaci osudu neuronálních buněk. Tato SHH-indukovaná diferenciální genová exprese vytváří ostré hranice mezi diskrétními doménami exprese transkripčního faktoru, což nakonec vzoruje ventrální nervovou trubici.
Prostorový a časový aspekt progresivní indukce genů a buněčných osudů ve ventrální neurální trubici je ilustrován expresními doménami dvou z nejlépe charakterizovaných transkripčních faktorů, Olig2 a Nkx2.2. Na počátku vývoje byly buňky ve ventrální střední linii vystaveny nízké koncentraci SHH pouze relativně krátkou dobu a exprimovaly transkripční faktor Olig2. Exprese Olig2 se rychle rozšiřuje v dorzálním směru souběžně s kontinuálním dorzálním prodlužováním gradientu SHH v průběhu času. Jak se však morfogenetická přední část ligandu SHH pohybuje a začíná růst koncentrovaněji, buňky, které jsou vystaveny vyšším hladinám ligandu, reagují vypnutím Olig2 a zapnutím Nkx2.2, čímž se vytvoří ostrá hranice mezi buňkami exprimujícími transkripční faktor Nkx2.2 ventrální k buňkám exprimujícím Olig2. Tímto způsobem se předpokládá, že každá z domén šesti populací progenitorových buněk je postupně vzorována v celé neurální trubici gradientem koncentrace SHH. Vzájemná inhibice mezi páry transkripčních faktorů vyjádřených v sousedních doménách přispívá k rozvoji ostrých hranic; v některých případech však byl nalezen inhibiční vztah dokonce mezi páry transkripčních faktorů ze vzdálenějších domén. Zejména je uvedeno , že NKX2-2 exprimovaný v doméně V3 inhibuje IRX3 exprimovaný ve V2 a více dorzálních doménách, ačkoli V3 a V2 jsou odděleny další doménou označovanou MN.
Exprese SHH ve frontonasální ektodermální zóně (FEZ), což je signální centrum, které je zodpovědné za vzorovaný vývoj horní čelisti, reguluje kraniofaciální vývoj zprostředkující prostřednictvím rodiny miR-199 v FEZ. Specificky, SHH-dependentní signály z mozku regulují geny rodiny miR-199 s downregulací genů miR-199, která zvyšuje expresi SHH a vede k širším obličejům, zatímco upregulace genů miR-199 snižuje expresi SHH, což má za následek úzké tváře.
Vývoj zubů
Sonic hedgehog (SHH) je signální molekula, která je kódována stejným genovým sonickým ježkem. SHH hraje velmi důležitou roli v organogenezi a hlavně v kraniofaciálním vývoji. Vzhledem k tomu, že SHH je signální molekula, funguje primárně difúzí podél koncentračního gradientu, což ovlivňuje buňky různými způsoby. V raném vývoji zubů se SHH uvolňuje z primárního uzlu skloviny - signálního centra - aby poskytl informace o poloze v laterálním i planárním signalizačním vzoru ve vývoji zubů a regulaci růstu zubů. Zvláště SHH je potřebný pro růst epiteliálních cervikálních smyček, kde se vnější a vnitřní epitel spojují a tvoří rezervoár pro zubní kmenové buňky. Poté, co se apoptosují primární smaltované uzly, vytvoří se sekundární smaltované uzly. Sekundární smaltované uzly vylučují SHH v kombinaci s dalšími signálními molekulami, aby zesílily orální ektoderm a začaly vzorovat složité tvary korunky zubu během diferenciace a mineralizace. V knockoutovém genovém modelu absence SHH svědčí o holoprosencefalii . SHH však aktivuje navazující molekuly Gli2 a Gli3. Embrya mutantních Gli2 a Gli3 mají abnormální vývoj řezáků, které jsou zastaveny v časném vývoji zubů, stejně jako malé stoličky.
Vývoj plic
Přestože je SHH nejčastěji spojována s vývojem číslic mozku a končetin, je také důležitá ve vývoji plic. Studie využívající qPCR a knockouty prokázaly, že SHH přispívá k embryonálnímu vývoji plic. Rozvětvení plic savce se vyskytuje v epitelu vyvíjejících se průdušek a plic. SHH se exprimuje v endodermu předního střeva (nejvnitřnější ze tří zárodečných vrstev) v distálním epitelu, kde se vyvíjejí embryonální plíce. To naznačuje, že SHH je částečně zodpovědný za rozvětvení plic. Další důkaz role SHH v rozvětvení plic byl pozorován u qPCR. Exprese SHH se vyskytuje ve vyvíjejících se plicích kolem 11. embryonálního dne a je silně exprimována v pupenech fetálních plic, ale nízko ve vyvíjejících se průduškách. Myším s nedostatkem SHH se může vyvinout tracheoezofageální píštěl (abnormální spojení jícnu a průdušnice). Navíc dvojitý (SHH-/-) knockoutovaný myší model vykazoval špatný vývoj plic. Plíce dvojitého knockoutu SHH neprošly lobací a rozvětvením (tj. Abnormální plíce vyvinuly pouze jednu větev ve srovnání s rozsáhle rozvětveným fenotypem divokého typu).
Potenciální regenerační funkce
Sonic ježek může hrát roli v regeneraci savčích vláskových buněk . Modulací aktivity proteinu retinoblastomu u krysího kochlea umožňuje zvukový ježek zralým vlasovým buňkám, které se normálně nemohou vrátit do proliferačního stavu, dělit se a diferencovat. Proteiny retinoblastomu potlačují buněčný růst tím, že brání buňkám v návratu do buněčného cyklu , čímž brání proliferaci. Zdá se, že inhibice aktivity Rb umožňuje rozdělení buněk. Sonický ježek - identifikovaný jako důležitý regulátor Rb - se proto také může ukázat jako důležitý rys při opětovném růstu vlasových buněk po poškození.
SHH je důležitý pro regulaci dermální adipogeneze buňkami zesilujícími tranzitní buňky vlasových folikulů (HF-TAC). Specificky SHH indukuje dermální angiogenezi přímým působením na prekurzory adipocytů a podporou jejich proliferace prostřednictvím exprese genu y (Pparg) aktivovaného peroxisomovým proliferátorem.
zpracovává se
SHH prochází řadou kroků zpracování, než je vylučován z buňky. Nově syntetizovaný SHH váží 45 kDa a je označován jako preproprotein. Jako sekretovaný protein obsahuje na svém N-konci krátkou signální sekvenci , která je rozpoznávána částicí rozpoznávající signál během translokace do endoplazmatického retikula (ER), což je první krok sekrece proteinu . Jakmile je translokace dokončena, signální sekvence je odstraněna signální peptidázou v ER. Tam SHH podléhá autoprocesu za vzniku 20 kDa N-koncové signalizační domény (SHH-N) a 25 kDa C-koncové domény bez známé signální role. Štěpení je katalyzováno proteázou v C-koncové doméně. Během reakce se na C-konec SHH-N přidá molekula cholesterolu . C-koncová doména tedy funguje jako intein a cholesterol transferáza. Další hydrofobní skupina , palmitát , se přidá k alfa-aminu N-koncového cysteinu SHH-N. Tato modifikace je nutná pro efektivní signalizaci, což má za následek 30násobné zvýšení účinnosti oproti nepalmitylované formě a provádí ji člen rodiny membránově vázané rodiny O-acyltransferáz, protein-cystein N-palmitoyltransferázy HHAT .
Robotnikinin
Byl nalezen potenciální inhibitor signální dráhy ježka a je mu přezdíváno „Robotnikinin“ - na počest nemesis Sonic the Hedgehog, Dr. Ivo „Eggman“ Robotnik .
Bývalá kontroverze kolem jména
Gen byl spojen se stavem známým jako holoprosencefalie , který může mít za následek vážné defekty mozku, lebky a obličeje, což přimělo několik kliniků a vědců, aby kritizovali název s odůvodněním, že to zní příliš frivolně. Bylo poznamenáno, že zmínka o mutaci v genu pro sonického ježka nemusí být dobře přijata v diskusi o závažné poruše s pacientem nebo jeho rodinou. Tato kontroverze do značné míry utichla a název je nyní obecně považován za vtipnou relikvii doby před vzestupem rychlého, levného kompletního sekvenování genomu a standardizované nomenklatury. Problém „nevhodnosti“ názvů genů jako „Matky proti dekapentaplegii“ , „Lunatic fringe“ a „Sonic ježko“ se do značné míry vyhneme používáním standardizovaných zkratek při rozhovoru s pacienty a jejich rodinami.
Galerie
Viz také
- Pikachurin , sítnicový protein pojmenovaný po Pikachu
- Zbtb7 , onkogen, který byl původně pojmenován „ Pokémon “
Reference
Další čtení
- Dorus S, Anderson JR, Vallender EJ, Gilbert SL, Zhang L, Chemnick LG, Ryder OA, Li W, Lahn BT (2006). „Sonic Hedgehog, klíčový vývojový gen, zažil u primátů intenzivnější molekulární evoluci“ . Lidská molekulární genetika . 15 (13): 2031–7. doi : 10,1093/hmg/ddl123 . PMID 16687440 .
- Gilbert, Scott F. (2000). Vývojová biologie (6. vydání). Sunderland, Mass: Sinauer Associates. ISBN 978-0-87893-243-6.
- Kim J, Kim P, Hui CC (2001). „Sdružení VACTERL: lekce z cesty Sonic Ježek“. Klinická genetika . 59 (5): 306–15. doi : 10,1034/j.1399-0004.2001.590503.x . PMID 11359461 . S2CID 34304310 .
- Morton JP, Lewis BC (2007). „Signalizace SHH a rakovina pankreatu: důsledky pro terapii?“ . Buněčný cyklus . 6 (13): 1553–7. doi : 10,4161/cc.6.13.4467 . PMID 17611415 . S2CID 4670615 .
- Mullor JL, Sánchez P, Ruiz i Altaba A (2003). „Cesty a důsledky: Ježek signalizace u lidských nemocí“. Trends Cell Biol . 12 (12): 562–9. doi : 10,1016/S0962-8924 (02) 02405-4 . PMID 12495844 .
- Nanni L, Ming JE, Du Y, Hall RK, Aldred M, Bankier A, Muenke M (2001). „Mutace SHH je spojena s osamělým středním maxilárním centrálním řezákem: studie 13 pacientů a přehled literatury“. American Journal of Medical Genetics . 102 (1): 1–10. doi : 10,1002/1096-8628 (20010722) 102: 1 <1 :: AID-AJMG1336> 3.0.CO; 2-U . PMID 11471164 .
- Williams JA (2006). „Ježek a poranění míchy“. Názor odborníka na terapeutické cíle . 9 (6): 1137–45. doi : 10,1517/14728222.9.6.1137 . PMID 16300466 . S2CID 5548531 .
externí odkazy
- Úvodní článek o SHH na Davidson College
- Znovuobjevení biologie: 7. blok Genetika vývoje .. Přepis expertního rozhovoru rozhovor s Johnem Incardonou PhD .. vysvětlení objevu a pojmenování sonického genu ježka
- „Sonic Hedgehog“ zněl nejprve legračně .. New York Times 12. listopadu 2006 ..
- GeneReviews/NCBI/NIH/UW entry on Anophthalmia/Microphthalmia Overview
- SHH - zvukový ježek US National Library of Medicine
- Přehled všech strukturálních informací dostupných v PDB pro UniProt : Q15465 (protein Hedgehog Human Sonic) na PDBe-KB .
- Přehled všech strukturálních informací dostupných v PDB pro UniProt : Q62226 (protein myšího ježka Sonic) na PDBe-KB .